Diabetes ist die häufigste Ursache für chronische Nierenerkrankung (CKD).
Die internationale Organisation «Kidney Disease: Improving Global Outcomes» (KDIGO) hat kürzlich neue Guidelines herausgegeben zum Management von Typ-2-Diabetes bei Menschen mit CKD. Es wird ein Behandlungsansatz propagiert, der auf mehreren Säulen fusst. Eine der Key Messages: das Fortschreiten der Nierenerkrankung kann mit neuen Medikamenten verlangsamt werden, so dass vielen die Dialyse über eine lange Zeit erspart bleibt.
Während früher nur wenige Therapieoptionen zur Verfügung standen, welche die Progredienz der diabetesassoziierten CKD aufhalten konnten, gibt es aktuell mehrere moderne Klassen von Medikamenten, welche den Nierenfunktionsverlust deutlich verlangsamen können, wenn sie rechtzeitig zum Einsatz kommen. Daher ist es wichtig, dass die Betroffenen rechtzeitig von einem Nephrologen mitbetreut werden [1]. «Kriterien zur Vorstellung des Menschen mit Diabetes mellitus beim Nephrologen sind beispielsweise: neuer oder deutlicher eGFR-Abfall, eGFR ≤60 ml/min/1,73 m², Erythrozyturie oder eine Albuminurie Grad 2 oder 3», erklärte Prof. Dr. med. Julia Weinmann-Menke, Mainz, Pressesprecherin der Deutschen Gesellschaft für Nephrologie [1,3].
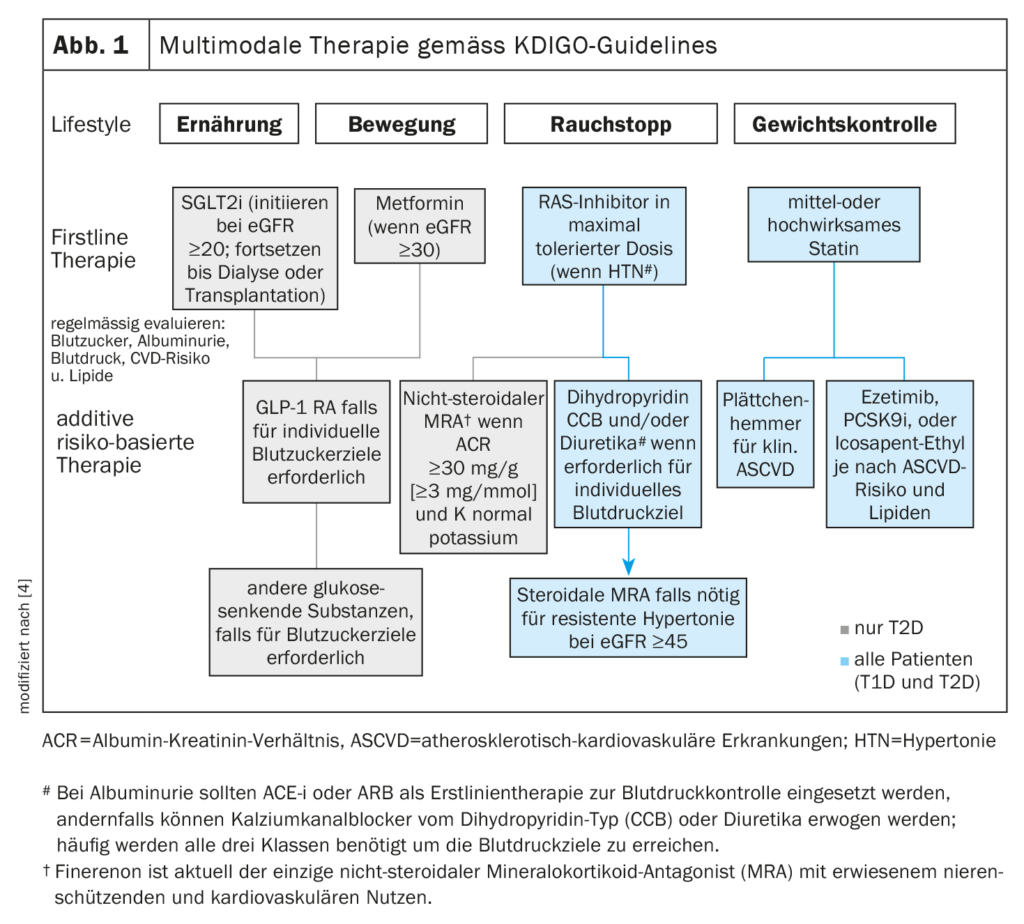
Dass die 2020 herausgegebenen KDIGO-Guidelines bereits 2022 in einer überarbeiteten Fassung vorliegen, widerspiegelt den rasanten Fortschritt auf dem Gebiet der Behandlung von diabetes-assoziierter Nephropathie [4]. Die KDIGO propagiert einen multimodalen Therapieansatz (Abb. 1).
- Alle Patienten sollten auf die Lebensstilfaktoren Bewegung, Ernährung und Rauchstopp achten. Die medikamentösen Erstlinientherapien gilt es entsprechend der individuellen klinischen Merkmale auszuwählen.
- Die Blutzuckerkontrolle basiert bei Typ-2-Diabetes (T2D) auf einer Kombination aus Metformin und Natrium-Glukose-Cotransporter-2-Inhibitoren (SGLT-2-i). Für Patienten, bei welchen SGLT-2-i und Metformin nicht zielführend sind, um die Blutzuckerziele zu erreichen, sind Glucagon-like Peptide-1-Rezeptor-Agonisten (GLP-1 RA) die bevorzugte glukosesenkende Medikation.
- Bei Patienten mit Albuminurie und Bluthochdruck (HTN) wird zu einer Hemmung des Renin-Angiotensin-Systems (RAS) geraten. Ein Statin wird für alle Patienten mit T1D oder T2D und CKD empfohlen.
- Ein nichtsteroidaler Mineralokortikoidrezeptor-Antagonist (ns-MRA) kann bei Patienten mit T2D und einem hohen Restrisiko für das Fortschreiten der CKD und für kardiovaskuläre Ereignisse** zur Erstlinientherapie hinzugefügt werden.
- Aspirin wird bei Patienten mit etablierten kardiovaskulären Erkrankungen im Allgemeinen lebenslang zur Sekundärprävention eingesetzt, sofern keine Kontraindikationen bestehen und kann zur Primärprävention bei Patienten mit hohem Risiko für atherosklerotische kardiovaskuläre Erkrankungen (ASCVD) in Betracht gezogen werden.
** Indikator für hohes Restrisiko für das Fortschreiten der CKD und für kardiovaskuläre Ereignisse: anhaltende Albuminurie (>30 mg/g [>3 mg/mmol])

SGLT-2-i: der eGFR-Schwellenwert wurde gesenkt
Patienten mit T2D, CKD und einer eGFR ≥20 ml/min pro 1,73 m² sind inzwischen in RCTs zu SGLT-2-i umfassend untersucht worden. Aufgrund dieser Studien wird die nachdrückliche Empfehlung bekräftigt, Patienten mit T2D und CKD mit einem SGLT-2-i zu behandeln, unabhängig von der Albuminurie. Eine wichtige Änderung ist die niedrigere eGFR-Schwelle, bei der SGLT-2-i eingeleitet werden sollten. Die Leitlinie 2022 empfiehlt die Einführung eines SGLT-2-i für Patienten mit T2D und CKD, die eine eGFR ≥20 ml/min pro 1,73 m² aufweisen, im Gegensatz zu ≥30 ml/min pro 1,73 m² in der Leitlinie 2020 [4].

Die Studien Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease (DAPA-CKD) und Effect of Sotagliflozin on Cardiovascular and Renal Events in Patients with Type 2 Diabetes and Moderate Renal Impairment Who Are at Cardiovascular Risk (SCORED) nahmen CKD-Patienten mit einer eGFR von bis zu 25 ml/min pro 1,73 m² auf [5,6].
An der Study of Heart and Kidney Protection with Empagliflozin (EMPA-KIDNEY), die ausschliesslich mit CKD-Populationen durchgeführt und wegen des Nutzens vorzeitig abgebrochen werden konnte, nahmen auch Teilnehmer mit einer eGFR ≥20 ml/min pro 1,73 m² teil [7]. Subgruppenanalysen einzelner Studien und Metaanalysen haben Vorteile für die Nieren und das Herz-Kreislauf-System in allen eGFR-Kategorien gezeigt, einschliesslich bei Teilnehmern mit eGFR <30 ml/min pro 1,73 m² und bei denjenigen ohne Albuminurie [8,9].

GLP-1-Rezeptor-Agonisten: neue Erkenntnisse
Im Jahr 2021 wurden die Ergebnisse einer neuen grossen Endpunktstudie zu Efpeglenatid veröffentlicht, welche in die neuen KDIGO-Guidelines eingeflossen sind. Die Studie AMPLITUDE-O (Effect of Efpeglenatide on Cardiovascular Outcomes) untermauerte die Belege für die kardiovaskulären Vorteile von GLP-1 RA und bekräftigte die Hypothese, dass GLP-1 RA auch die Nierenwerte verbessern können [2]. Demnach bleiben GLP-1 RA die empfohlene Zweitlinientherapie zur Senkung des Blutzuckerspiegels bei T2D und CKD. Der nachgewiesene kardiovaskuläre Nutzen von GLP-1 RA wurde für alle Kategorien der eGFR nachgewiesen und diente als Hauptargument für die Empfehlung, GLP-1 RA bei Patienten mit T2D und CKD, die trotz der Anwendung von SGLT-2-i und Metformin ihre Blutzuckerziele nicht erreichten (oder bei welchen SGLT-2-i und/oder Metformin nicht eingesetzt werden konnten) als bevorzugtes Medikament zur Senkung des Blutzuckerspiegels einzusetzen.
Finerenon – nicht-steroidaler Mineralokortikoid-Antagonist als neuster Player
Ebenfalls wirksam in der Verhinderung der Progression der diabetischen Nierenkrankheit ist der neuartige, nicht-steroidale, selektive Mineralokortikoid-Rezeptor-Antagonist Finerenon [1]. Dies zeigten die zwei grossen klinischen Studien FIDELIO-DKD (Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease) [10] und FIGARO-DKD (Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease) [11] sowie die darauf basierende kombinierte Analyse FIDELITY [12]. Die wichtigsten Ergebnisse im Überblick:
In der FIDELIO-DKD-Studie reduzierte Finerenon signifikant die Inzidenz sowohl des primären zusammengesetzten Nierenergebnisses (Nierenversagen, anhaltende Abnahme der eGFR um ≥40% oder Tod aufgrund von Nierenerkrankungen; Hazard Ratio [HR]: 0,82; 95%-KI: 0,73–0,93) und das sekundäre zusammengesetzte kardiovaskuläre Ergebnis (Tod durch kardiovaskuläre Ursachen, nicht tödlicher Herzinfarkt, nicht tödlicher Schlaganfall oder Krankenhausaufenthalt wegen Herzinsuffizienz; HR: 0,86; 95%-K1I: 0,75–0,99) [10].
In FIGARO-DKD reduzierte Finerenon signifikant den kombinierten kardiovaskulären Endpunkt (HR: 0,87; 95%-KI: 0,76–0,98) [11].
In der FIDELITY-Studie wurde das kardiovaskuläre Gesamtergebnis bei den mit Finerenon behandelten Patienten reduziert (HR: 0,86; 95%-KI: 0,78–0,95), ohne dass eine signifikante Heterogenität in Bezug auf die Patientenmerkmale bei Baseline vorlag [12].
Bei den mit Finerenon behandelten Patienten kam es auch seltener zu einem Nierenversagen, einer Abnahme der eGFR um mehr als 57% oder zu einem nierenbedingten Tod (HR: 0,77; 95%-KI: 0,67–0,88) und seltener zu einem Nierenversagen, definiert als Beginn einer chronischen Dialyse oder Nierentransplantation (HR: 0,80; 95%-KI: 0,64–0,99).
Literatur:
- «Weltdiabetestag: Dialyse ist kein unabwendbares Schicksal bei Menschen mit Diabetes mellitus!», Deutsche Gesellschaft für Nephrologie, 11.11.2022
- Gerstein HC, et al.: N Engl J Med 2021; 385: 896–907.
- Positionspapier Kooperation Diabetologie/Nephrologie. Deutsche Diabetes-Gesellschaft/Deutsche Gesellschaft für Nephrologie/Verein der leitenden Krankenhausnephrologen 2018. www.ddg.info, (letzter Abruf 10.01.2023)
- Rossing P, et al.: Executive summary of the KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease: an update based on rapidly emerging new evidence. Kidney Int 2022; 102(5): 990–999.
- Bhatt DL, et al.: N Engl J Med 2021; 384: 117–128.
- Heerspink HJL, et al.: N Engl J Med 2020; 383: 1436–1446.
- EMPA-Kidney Collaborative Group: Nephrol Dial Transplant 2022; 37; 1317–1329.
- Bakris G, et al.: Clin J Am Soc Nephrol 2020; 15: 1705–1714.
- Chertow GM, et al.: J Am Soc Nephrol 2021; 32: 2352–2361.
- Bakris GL, et al.: N Engl J Med 2020; 383: 2219–2229.
- Pitt B, et al.: N Engl J Med 2021; 385: 2252–2263.
- Rossing P, et al.: FIDELIO-DKD and FIGARO-DKD Investigators: Diabetes Care. Published online, August 15 (2022), 10.2337/dc22-0294
- Seidu S, et al.: 2022 update to the position statement by Primary Care Diabetes Europe: a disease state approach to the pharmacological management of type 2 diabetes in primary care. Prim Care Diabetes 2022; 16(2): 223–244.
- «Chronic Kidney Disease-associated Pruritus: From Epidemiology To Treatment», 25.11.2021, www.emjreviews.com, (letzter Abruf 14.12.2022)
- Sukul N, et al.: Kidney Med 2020; 3(1): 42-53.e1
- Yan B, et al.: J Am Heart Assoc 2021; 10(7): e016201.
- «CHMP Meeting Highlights Februar 2022», 17.03.2022, www.basg.gv.at, (letzter Abruf 14.12.2022)
- Fishbane S; KALM-1 Trial Investigators: N Engl J Med 2020; 382(3): 222–232.
- American Society of Nephrology: Abstract FR-OR24, www.asn-online.org (letzter Abruf 14.12.2022)
HAUSARZT PRAXIS 2023; 18(1): 20–21